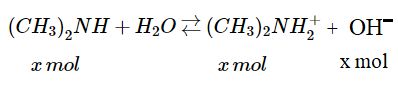Bài 1.35* trang 8 Sách bài tập (SBT) Hóa học 11 Nâng caoGiải bài 1.35* trang 8 Sách bài tập (SBT) Hóa học 11 Nâng cao. 1. Viết biểu thức tính hằng số phân li bazơ của đimetylamin. Đimetylamin \({(C{H_3})_2}NH + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) \({(C{H_3})_2}NH_2^ + + O{H^ - }\) 1. Viết biểu thức tính hằng số phân li bazơ \({K_b}\) của đimetylamin. 2. Tính pH của dung dịch đimetylamin 1,5M biết rằng \({K_b} = 5,{9.10^{ - 4}}\) Giải : \(1.\,{K_b} = {{\left[ {{{(C{H_3})}_2}NH_2^ + } \right].\left[ {O{H^ - }} \right]} \over {\left[ {{{(C{H_3})}_2}NH} \right]}}\) 2. Trong 1 lít dung dịch có 1,5 mol \({(C{H_3})_2}NH\). Giả sử x mol chất này có phản ứng với nước :
Vì \({K_b} = 5,{9.10^{ - 4}}\) lớn hơn rất nhiều so với tích số ion của nước \(({1.10^{ - 4}})\) nên có thể bỏ qua phần \(O{H^ - }\) sinh ra do sự điện li của nước. Khi cân bằng, \(\left[ {{{(C{H_3})}_2}NH_2^ + } \right] = \left[ {O{H^ - }} \right] = x\) Nồng độ đimetylamin \(\left[ {{{\left( {C{H_3}} \right)}_2}NH} \right] = (1,5 - x)\) Vì \({K_b}\) nhỏ nên 1,5-x coi như bằng 1,5 \({K_b} = {{{x^2}} \over {1,5}} = 5,{9.10^{ - 4}};\)\(x = \sqrt {1,5.5,{{9.10}^{ - 4}}} \approx 3,{0.10^{ - 2}}(mol).\) Nồng độ \(O{H^ - }\) là \(3,{0.10^{ - 2}}\) do đó nồng độ \( {H^ + }\) là \(\left[ {{H^ + }} \right] = {{1,{{0.10}^{ - 14}}} \over {3,{{0.10}^{ - 2}}}} \approx 3,{3.10^{ - 13}}(mol/l)\) pH của dung dịch điêmtylamin 1,5M là \(pH = - \lg \left[ {{H^ + }} \right] = 12,48\) . Sachbaitap.com
Xem thêm tại đây:
Bài 5: Luyện tập: axit, bazơ và muối
|
-

Bài 1.36 trang 8 Sách bài tập (SBT) Hóa học 11 Nâng cao
Giải bài 1.36 trang 8 Sách bài tập (SBT) Hóa học 11 Nâng cao. Dung dịch axit fomic 0,007M có pH=3,0. 1. Tính độ điện li của axit fomic trong dung dịch đó.
-

Bài 1.37 trang 9 Sách bài tập (SBT) Hóa học 11 Nâng cao
Giải bài 1.37 trang 9 Sách bài tập (SBT) Hóa học 11 Nâng cao. Có hai bình, mỗi bình đều chứa 1 lít dung dịch NaCl 0,1M. Đổ vào bình thứ nhất 1 lít dung dịch 0,1M và đổ vào bình thứ hai 1 lít dung dịch 0,1M.
-

Bài 1.38 trang 9 Sách bài tập (SBT) Hóa học 11 Nâng cao
Giải bài 1.38 trang 9 Sách bài tập (SBT) Hóa học 11 Nâng cao. Có thể xảy ra phản ứng trong đó một axit yếu đẩy một axit mạnh ra khỏi dung dịch muối được không ? Vì sao? Cho thí dụ.
-

Bài 1.39 trang 9 Sách bài tập (SBT) Hóa học 11 Nâng cao
Giải bài 1.39 trang 9 Sách bài tập (SBT) Hóa học 11 Nâng cao. Có ba dung dịch : kali sunfat, kẽm sunfat và kali sunfit với nồng độ khoảng 0,1M. Chỉ dùng một thuốc thử có thể nhận ra được ba dung dịch trên đó.

 Tải ngay
Tải ngay