Bài 14.3 trang 35 Sách bài tập (SBT) Vật Lí 11Một bình điện phân chứa dung dịch muối niken với hai điện cực bằng niken. Xác định khối lượng niken bám vào catôt khi cho dòng điện cường độ I = 5,0 A chạy qua bình này trong khoảng thời gian t = 1 giờ. Đương lượng điện hoá của niken là 0,3.10-3 g/C. Một bình điện phân chứa dung dịch muối niken với hai điện cực bằng niken. Xác định khối lượng niken bám vào catôt khi cho dòng điện cường độ I = 5,0 A chạy qua bình này trong khoảng thời gian t = 1 giờ. Đương lượng điện hoá của niken là 0,3.10-3 g/C. A. 1,5 kg. B. 5,4 g. C. 1,5 g. D. 5,4 kg. Trả lời: Đáp án B Khối lượng của niken được giải phóng ra ở điện cực của bình điện phân tuân theo định luật I Fa-ra-đây : m = kq = kIt trong đó k là đương lượng điện hoá của niken, q = It là điện lượng chuyển qua dung dịch điện phân. Thay số, ta tìm được : m = 0,3.10-3.5,0.3600 = 5,4g. Sachbaitap.com
Xem lời giải SGK - Vật lí 11 - Xem ngay >> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
Xem thêm tại đây:
Bài 14: Dòng điện trong chất điện phân
|
-
Bài 14.4 trang 35 Sách bài tập (SBT) Vật Lí 11
Một bình điện phân chứa dung dịch đồng sunphat (CuS04) có anôt bằng đồng. Cho dòng điện không đổi chạy qua bình này trong thời gian 30 phút, khi đó khối lượng của catôt tăng thêm 1,143 g. Xác định cường độ dòng điện chạy qua bình điện phân. Đồng (Cu) có khối lượng mol là của A = 63,5 g/mol.
-
Bài 14.9 trang 36 Sách bài tập (SBT) Vật Lí 11
Khi điện phân dung dịch nhôm ôxit Al2O3 nóng chảy, người ta cho dòng điện cường độ 20 kA chạy qua dung dịch này tương ứng với hiệu điện thế giữa các điện cực là 5,0 V. Nhôm có khối lượng mol là A = 27 g/mol và hoá trị n = 3. Xác định khoảng thời gian điện phân để thu được 1 tấn nhôm và lượng điện năng đã tiêu thụ trong quá trình điện phân này bằng bao nhiêu ?
-
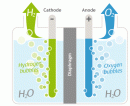
Bài 14.12* trang 36 Sách bài tập (SBT) Vật Lí 11
Khi điện phân dung dịch muối ăn NaCl trong binh điện phân có điện cực anôt bằng graphit, người ta thu được khí clo ở anôt và khí hiđrô ở catôt. a) Giải thích kết quả của quá trình điện phân này dựa theo thuyết điện li. b) Xác định thể tích của các khí thu được ở điều kiện chuẩn khi điện phân trong khoảng thời gian t = 10 phút với cường độ dòng điện I = 10 A.
-
Bài 14.10* trang 36 Sách bài tập (SBT) Vật Lí 11
Xác định khối lượng đồng bám vào catôt của bình điện phân chứa dung dịch đồng sunphat (CuSO4) khi dòng điện chạy qua bình này trong 1 phút và có cường độ thay đổi theo thời gian với quy luật I = 0,05.t (A). Đồng có khối lượng mol là A = 63,5 g/mol và hoá trị n = 2.

 Tải ngay
Tải ngay







