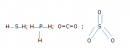Bài 22.1 Trang 29 Sách bài tập (SBT) Hóa học 8Đốt cháy 3,25 g một mẫu lưu huỳnh không tinh khiết trong khí oxi dư, người ta thu được 2,24 lít khí sunfurơ (đktc). Đốt cháy 3,25 g một mẫu lưu huỳnh không tinh khiết trong khí oxi dư, người ta thu được 2,24 lít khí sunfurơ (đktc). a) Hãy viết phương trình hoá học xảy ra. b) Bằng cách nào ta có thể tính được độ tinh khiết của mẫu lưu huỳnh đã dùng ? c) Căn cứ vào phương trình hoá học trên, ta có thể trả lời ngay được thể tích khí oxi (đktc) vừa đủ để đốt cháy lun huỳnh là bao nhiêu lít ? Giải a) Phương trình hoá học : \(S + {O_2} \to S{O_2}\) b) Độ tinh khiết của mẫu lưu huỳnh : - Số mol khí \(S{O_2}\) sinh ra sau phản ứng : \({n_{S{O_2}}} = {{2,24} \over {22,4}} = 0,1(mol)\) - Theo phương trình hoá học, để sinh ra 0,1 mol \(S{O_2}\) phải có 0,1 mol S, có khối lượng là 32 x 0,1 = 3,2 (g). Đây là lượng S tinh khiết có trong 3,25 g mẫu lưu huỳnh đã dùng. Độ tinh khiết của mẫu lưu huỳnh là : \({{3,2 \times 100\% } \over {3,25}} \approx 98,5\% \) c) Thể tích khí oxi tham gia phản ứng : Dựa vào phương trình hoá học, em thấy số mol \(S{O_2}\) bằng số mol \({O_2}\). Để có lít \(S{O_2}\) cần 2,24 lít \({O_2}\)
Xem lời giải SGK - Hóa 8 - Xem ngay >> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
Xem thêm tại đây:
Bài 22: Tính theo phương trình hóa học
|
-
Bài 22.2 Trang 29 Sách bài tập (SBT) Hóa học 8
Trong phòng thí nghiệm, người ta có thể điều chế khí oxi bằng cách đốt nóng kali clorat:
-

Bài 22.3 Trang 29 Sách bài tập (SBT) Hóa học 8
Cho khí hiđro dư đi qua đồng(II) oxit nóng màu đen, người ta thu được 0,32 g kim loại đồng màu đỏ và hơi nước ngưng tụ.
-

Bài 22.4 Trang 30 Sách bài tập (SBT) Hóa học 8
Đốt nóng 1,35 g bột nhôm trong khí clo, người ta thu được 6,675 g nhôm clorua. Em hãy cho biết:
-
Bài 22.5 Trang 30 Sách bài tập (SBT) Hóa học 8
Đốt khí hiđro trong khí oxi người ta nhận thấy cứ 2 thể tích hiđro kết hợp với 1 thể tích oxi tạo thành nước.

 Tải ngay
Tải ngay