Bài 5.113 trang 51 sách bài tập (SBT) Hóa học 12Chia 100 g dung dịch muối có nồng độ 6,8% làm hai phần bằng nhau. -Phần một cho tác dụng với dung dịch NaOH dư, tạo ra một bazơ không tan, làm khô chất này thu được một oxit có khối lượng 2,32 g. Chia 100 g dung dịch muối có nồng độ 6,8% làm hai phần bằng nhau. - Phần một cho tác dụng với dung dịch NaOH dư, tạo ra một bazơ không tan, làm khô chất này thu được một oxit có khối lượng 2,32 g. - Phần hai cho tác dụng với dung dịch NaCl dư thu được 2,87 g kết tủa không tan trong dung dịch axit. a) Xác định công thức hoá học của muối có trong dung dịch ban đầu. b) Trình bày các phương pháp hoá học điểu chế kim loại từ muối tìm được ở trên. Hướng dẫn trả lời: a) Đặt công thức của muối là AmBn. Khối lượng mol của A, B là X, Y. Khối lượng muối trong mỗi phần là 3,4 g. Ta có sơ đồ biến đổi các ch trong thí nghiệm 1 : \(2{A_m}{B_n}\buildrel {NaOH} \over Theo sơ đồ : 2(mX + nY) g AmBn tạo thành m(2X + 16n) g A2On. Theo bài toán : 3,4 g AmBn →2,32 g A2On Ta có phương trình : 3,4m(2X + 16n) = 2,32.2(mX + nY) (1) Sơ đồ biến đổi các chất trong thí nghiệm 2 : \({A_m}{B_n}\buildrel {NaCl} \over Theo sơ đồ : (mX + nY) g AmBn tạo thành m(X + 35,5n) g ACln. Theo bài toán : 3,4 g AmBn →2,87 g ACln Ta có phương trình : 3,4m(X + 35,5n) = 2,87(mX + nY) (2) Chia ( 1 ) cho (2) ta được \({{2X + 16n} \over {X + 35,5n}} = {{4,46} \over {2,87}} \to X = 108n\) Giá trị có thể chấp nhận là n = 1 và X = 108. Vậy kim loại A là Ag. Thay n = 1 và X = 108 vào (1) hoặc (2) ta có Y = 62m. Gốc axit trong m bạc không thể là gốc halogenua hoặc sunfua mà là gốc axit có oxi có khối lượng 62, gốc đó là NO3- Vậy công thức hoá học của muối là AgNO3. b) Điều chế Ag từ AgNO3 : Dùng kim loại mạnh hơn Ag để đẩy Ag : Cu + 2AgNO3 →Cu(NO3)2 + 2Ag Nhiệt phân : \(AgN{O_3}\buildrel {{t^0}} \over Điện phân với điện cực trơ : \(4AgN{O_3} + {\rm{ }}2{H_2}O\buildrel {dp{\rm{dd}}} \over Sachbaitap.com
Xem lời giải SGK - Hóa 12 - Xem ngay >> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
Xem thêm tại đây:
Bài 22. Luyện tập. TÍNH CHẤT CỦA KIM LOẠI
|
-

Bài 5.114 trang 51 sách bài tập (SBT) Hóa học 12
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HC1, sau khi thu được 336 ml H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Xác định kim loại đã dùng
-

Bài 5.115 trang 52 sách bài tập (SBT) Hóa học 12
Trong một bình kín dung tích không đổi 16,8 lít chứa khí Cl2 (đktc) và một ít bột kim loại M.
-
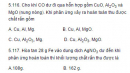
Bài 5.116, 5.117, 5.118 trang 52 sách bài tập (SBT) Hóa học 12
Cho khí CO dư đi qua hỗn hợp gồm CuO, A12O3 và MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm
-

Bài 5.119, 5.120, 5.121 trang 53 sách bài tập (SBT) Hóa học 12
5.119. Cuốn một sợi dây thép vào một thanh kim loại rồi nhúng vào dung dịch H2SO4 loãng. Quan sát thấy bọt khí thoát ra rất nhanh từ sợi dây thép. Thanh kim loại đã dùng có thể là

 Tải ngay
Tải ngay







