Bài 5.29 trang 38 sách bài tập (SBT) Hóa học 12Ngâm một đinh sắt sạch trong 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch, rửa nhẹ, làm khô, nhận thấy khối lượng đinh sắt tăng thêm 0,8 g. Ngâm một đinh sắt sạch trong 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch, rửa nhẹ, làm khô, nhận thấy khối lượng đinh sắt tăng thêm 0,8 g. a) Viết phương trình hoá học của phản ứng dạng phân tử và ion thu gọn. Cho biết vai trò của các chất tham gia phản ứng. b) Tính nồng độ mol của dung dịch CuSO4. Giả thiết Cu giải phóng ra đều bám hết vào đinh sắt. Hướng dẫn trả lời a) Fe + CuSO4 → FeSO4 + Cu (1) Fe + Cu2+ → Fe2+ + Cu (2) Chất khử chất oxi hóa b) Theo (1) cứ 1 mol CuSO4 phản ứng làm khối lượng đinh sắt tăng 8 g x mol <-------------------------------------------------------- 0,8 g \(x = {{1.0,8} \over 8} = 0,1(mol)\) Nồng độ mol của dung dịch CuSO4 là : \({{0,1.1000} \over {200}} = 0,5(M)\). Sachbaitap.com
Xem lời giải SGK - Hóa 12 - Xem ngay >> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
Xem thêm tại đây:
Bài 18. TÍNH CHẤT CỦA KIM LOẠI. DÃY ĐIỆN HÓA CỦA KIM LOẠI
|
-

Bài 5.22, 5.23, 5.24, 5.25, 5.26 trang 37 sách bài tập (SBT) Hóa học 12
5.22.Phản ứng : Cu + 2FeCl3 >2FeCl2 +CuCl2 chứng tỏ
-

Bài 5.27 trang 37 sách bài tập (SBT) Hóa Học 12
Viết phương trình hoá học dạng phân tử và ion thu gọn của các phản ứng xảy ra (nếu có). Cho biết vai trò của các chất tham gia phản ứng.
-
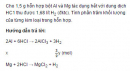
Bài 5.30 trang 38 sách bài tập (SBT) Hóa học 12
Cho 1,5 g hỗn hợp bột Al và Mg tác dụng hết với dung dịch HC1 thu được 1,68 lít H2 (đktc). Tính phần trăm khối lượng của từng kim loại trong hỗn hợp.
-

Bài 5.31 trang 38 sách bài tập (SBT) Hóa học 12
Đốt cháy hết 1,08 g một kim loại hoá trị III trọng khí Cl2 thu được 5,34 g muối clorua của kim loại đó. Xác định kim loại.

 Tải ngay
Tải ngay







