Bài 6.33 trang 63 Sách bài tập (SBT) Hóa học 10Ba thí nghiệm được tiến hành với những khối lượng Zn bằng nhau và với (50 cm^3) dung dịch loãng (H_2SO_4) 2M. PTHH của phản ứng : Ba thí nghiệm được tiến hành với những khối lượng Zn bằng nhau và với \(50 cm^3\) dung dịch loãng \(H_2SO_4\) 2M. PTHH của phản ứng : \(Zn + H_2SO_4 → ZnSO_4 + H_2↑\) Bảng dưới đây cho biết các điều kiện của mỗi thí nghiệm :
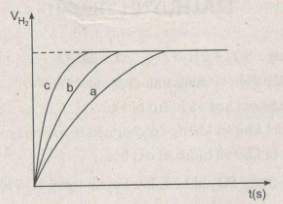
Khí hiđro thu được trong mỗi thí nghiệm được ghi lại theo những khoảng cách nhất định về thời gian cho đến khi phản ứng kết thúc, được biểu diễn bằng đồ thị sau :
a) Rút ra được những nhận xét gì khi so sánh hiện tượng phản ứng của : - Thí nghiệm 1 và thí nghiệm 3 ? - Thí nghiệm 2 và thí nghiệm 3 ? b) Hãy quan sát đồ thị trên để cho biết các đường cong a, b, c biểu thị cho những thí nghiệm nào ? c) Ghi thể tích khí \(H_2\) trên trục y khi phản ứng kết thúc. Biết rằng ở điều kiện phòng thí nghiệm, 1 mol khí có thể tích là 24 lít và Zn còn dư sau các thí nghiệm. Lời giải: a) Nhận xét: - Khí hiđro được giải phóng ở thí nghiệm 1 nhiều, nhanh hơn ở thí nghiệm 3. Vì diện tích tiếp xúc của Zn với \(H_2SO_4\) ở thí nghiệm 1 lớn hơn. trong khi đó nhiệt độ của dung dịch axit là như nhau. - Khí hiđro được giải phóng ở thí nghiệm 3 nhiều, nhanh hơn ở thí nghiệm 2. Vì nhiệt độ của dung dịch \(H_2SO_4\) ở thí nghiệm 3 cao hơn, trong khi đó diện tích tiếp xúc giữa Zn và axit là như nhau. b) Đồ thị biểu diễn các phản ứng : Đường cong c biểu diễn cho thí nghiệm 1, phản ứng xảy ra nhanh nhất Đường cong b biểu diễn cho thí nghiệm 3, phản ứng xảy ra nhanh trung bình. Đường cong a biểu diễn cho thí nghiệm 2, phản ứng xảy ra chậm nhất. c) Thể tích khí hiđro : Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng \(H_2SO_4\) tham gia phản ứng : \({n_{{H_2}}} = {n_{{H_2}S{O_4}}} = {{2.50} \over {1000}} = 0,1\left( {mol} \right)\) Thể tích khí hiđro ở điều kiện phòng là : \(V_{H_2}\) = 24.0,1 = 2,4 (lít) hoặc 2400 \(cm^3\) Ta ghi số 2400 \(cm^3\) trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).
Sachbaitap.com
Xem lời giải SGK - Hóa 10 - Xem ngay >> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
Xem thêm tại đây:
BÀI 32. HIDRO SUNFUA - LƯU HUỲNH DIOXIT - LƯU HUYNH TRIOXIT
|
-
Bài 6.34 trang 64 Sách bài tập (SBT) Hóa học 10
Trong phòng thí nghiêm, bạn em khảo sát thí nghiệm dùng dung dịch HCL dư tác dụng với một khối lượng nhỏ FeS. Cứ sau một khoảng cách thời gian là 20 giây, bạn em lại ghi thể tích khí thoát ra. Kết quả ghi được như sau (xem bảng) :
-

Bài 6.35 trang 65 Sách bài tập (SBT) Hóa học 10
Từ những chất sau : (Cu, S, H_2S, O_2, Na_2SO_3, H_2SO_4) đặc và dung dịch (H_2SO_4) loãng, hãy viết PTHH của phản ứng điều chế (SO_2).
-

Bài 6.36 trang 65 Sách bài tập (SBT) Hóa học 10
Đốt cháy hoàn toàn 3,4 gam hợp chất A, thu được 2,24 lít khí (SO2) (đktc) và 1,8 gam (H2O). a)Hãy xác định công thức phân tử của hợp chất A.
-

Bài 6.37 trang 65 Sách bài tập (SBT) Hóa học 10
Viết phương trình hoá học của các phản ứng, hoàn thành chuỗi biến hoá sau :

 Tải ngay
Tải ngay