Bài 6.50 trang 63 Sách bài tập (SBT) Hóa học 10 Nâng caoGiải bài 6.50 trang 63 Sách bài tập (SBT) Hóa học 10 Nâng cao. Nghiên cứu thí nghiệm hóa học giữa kim loại Mg và dung dịch H2SO4 loãng (dư) bằng cách đo thể tích khí hiđro thu được sau mỗi khoảng thời gian là 5 giây. Được các kết quả ghi trong bảng dưới đây. Bài 6.50 trang 63 SBT Hóa Học 10 Nâng cao Nghiên cứu thí nghiệm hóa học giữa kim loại Mg và dung dịch H2SO4 loãng (dư) bằng cách đo thể tích khí hiđro thu được sau mỗi khoảng thời gian là 5 giây. Được các kết quả ghi trong bảng dưới đây.
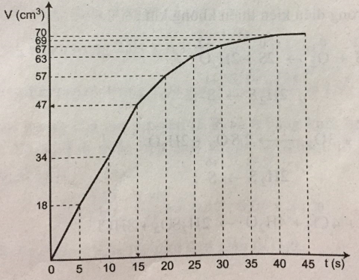
3. Trong khoảng thời gian nào thì phản ứng xảy ra nhanh nhất? 4. Nếu dùng 0,075 g Mg cho thí nghiệm này thì: a) Ở thời điểm nào sẽ còn lại 0,025 g Mg chưa tham gia phản ứng? b) Cần thời gian bao lâu để 0,075 g Mg phản ứng hết với axit? Giải 1. Phương trình hóa học: \(Mg + {H_2}S{O_4}\,\, \to \,\,MgS{O_4} + {H_2}\) 2. Xem đồ thị
3. Thời gian 5 giây đầu tiên; 4. a) Thời điểm còn lại 0,025 g Mg. - Khối lượng Mg tham gia phản ứng: mMg = 0,075 – 0,025 = 0,05 (g). - Phương trình hóa học cho biết: 24g Mg tham gia phản ứng, sinh ra 22400 cm3 H2. 0,05 g Mg tham gia phản ứng, sinh ra \({{22400 \times 0,05} \over {24}} \simeq 47\,\left( {c{m^3}} \right)\,{H_2}\). - Đồ thị cho biết 47 cm3 khí hiđro thoát ra, ứng với thời gian là 15 giây. Vậy sau khi phản ứng xảy ra được 15 giây thì còn lại 0,025g Mg chưa tham gia phản ứng. b) Theo đồ thị, thời gian để 0,075 g Mg tác dụng hết với axit là 40 giây. Từ thời điểm này trở đi, khí hiđro không được sinh ra nữa. Sachbaitap.com
Xem thêm tại đây:
Bài 46: Luyện tập chương 6
|
-

Bài 6.51 trang 64 Sách bài tập (SBT) Hóa học 10 Nâng cao
Giải bài 6.51 trang 64 Sách bài tập (SBT) Hóa học 10 Nâng cao. Nguyên tố lưu huỳnh có các trạng thái oxi hóa là: -2, 0, +4, +6. Hãy viết công thức hóa học của những chất mà nguyên tố lưu huỳnh có số oxi hóa tương ứng.
-

Bài 6.52 trang 64 Sách bài tập (SBT) Hóa học 10 Nâng cao
Giải bài 6.52 trang 64 Sách bài tập (SBT) Hóa học 10 Nâng cao. Đốt cháy hoàn toàn 2,04 g hợp chất A, thu được 1,08 g H2O và 1,344 lít SO2 (ở đktc).

 Tải ngay
Tải ngay