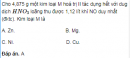Câu 5.26 trang 38 Sách bài tập (SBT) Hoá Nâng caoViết phương trình hóa học của các phản ứng. Xác định nồng độ mol của dung dịch Cho 1,68 g bột Fe và 0,36 g bột Mg tác dụng với 375 ml dung dịch \(CuS{O_4}\), khuấy nhẹ cho đến khi dung dịch mất màu xanh. Nhận thấy khối lượng kim loại thu được sau phản ứng là 2,82 g. a) Viết phương trình hoá học của các phản ứng. b) Xác định nồng độ mol của dung dịch \(CuS{O_4}\) trước phản ứng. Đáp số a) Các phương trình hoá học: Trước hết, Mg khử ion \(C{u^{2 + }}\) thành Cu: \(Mg + C{u^{2 + }} \to M{g^{2 + }} + Cu \downarrow \) (1) Sau đó, Fe khử ion \(C{u^{2 + }}\) thành Cu: \(Fe + C{u^{2 + }} \to F{e^{2 + }} + Cu \downarrow \) (2) b) Nồng độ mol của dung dịch \(CuS{O_4}\) ban đầu:
2,82 - (1,68+ 0,36) = 0,78 (g)
Số mol \(CuS{O_4}\) tham gia (2) là 0,0225 mol. Cuối cùng ta xác định được nồng độ của dung dịch \(CuS{O_4}\) là 0,1M. Sachbaitap.com
Xem lời giải SGK - Hóa 12 Nâng cao - Xem ngay >> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
Xem thêm tại đây:
Bài 20. Dãy điện hóa của kim loại
|

 Tải ngay
Tải ngay