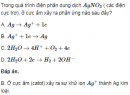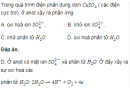Câu 5.35 trang 40 Sách bài tập (SBT) Hóa Nâng caoXác định kim loại A. Tính nồng độ mol của muối B trong dung dịch C. Cho 12,8 g kim loại A hoá trị II phản ứng hoàn toàn với khí \(C{l_2}\) thu được muối B. Hoà tan B vào nước để được 400 ml dung dịch C. Cho C phản ứng với thanh sắt nặng 11,2 g, sau một thời gian thấy kim loại A bám vào thanh sắt và khối lượng thanh sắt này tăng 0,8 g, nồng độ \(FeC{l_2}\) trong dung dịch là 0,25M. a) Xác định kim loại A. b) Tính nồng độ mol của muối B trong dung dịch C. Đáp án a) \(A + C{l_2} \to AC{l_2}\) (1) \(AC{l_2} + Fe \to FeC{l_2} + A\) (2) Theo (2) ta có : \({n_A} = {n_{Fe}}\)( phản ứng) \( = {n_{FeC{l_2}}} = 0,25.0,4 = 0,1\left( {mol} \right)\) Khối lượng sắt đã tham gia phản ứng là \({m_{Fe}} = 5,6g.\) Khối lượng thanh sắt tăng 0,8 g nghĩa là \({m_A} - {m_{Fe}} = 0,8g\) Vậy \({m_A} = 0,8 + 5,6 = 6,4\left( g \right)\) \({M_A} = {{6,4} \over {0,1}} = 64\left( {g/mol} \right) \Rightarrow \)Kim loại là Cu. b) \(\eqalign{ & {n_{Cu}} = {n_{CuC{l_2}}} = {{12,8} \over {64}} = 0,2\left( {mol} \right) \cr & {C_M}\left( {CuC{l_2}} \right) = 0,5M \cr} \) Sachbaitap.com
Xem lời giải SGK - Hóa 12 Nâng cao - Xem ngay >> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
Xem thêm tại đây:
Bài 21. Luyện tập: Tính chất của kim loại
|
-

Câu 5.36 trang 40 Sách bài tập (SBT) Hóa Nâng cao
Trong quá trình điện phân, những ion âm(anion) di chuyển về
-

Câu 5.39 trang 40 Sách bài tập (SBT) Hóa Nâng cao
a) Giải thích các hiện tượng quan sát được và viết phương trình ion- electron xảy ra ở các điện cực. b) Viết phương trình hóa học của sự điện phân.

 Tải ngay
Tải ngay