Câu 6.48 trang 57 Sách bài tập (SBT) Hóa Nâng caoTính nồng độ phần trăm của ion Ion \(SO_4^{2 - }\) có trong 20 g dung dịch \(CuS{O_4}\) tác dụng vừa đủ với ion \(B{a^{2 + }}\) có trong 26 ml dung dịch \(BaC{l_2}\) 0,02M. a) Tính nồng độ phần trăm của ion \(C{u^{2 + }}\) trong dung dịch ban đầu. b) Ngâm một lá nhôm trong dung dịch \(CuS{O_4}\) trên cho đến khi phản ứng kết thúc. Hãy cho biết khối lượng lá nhôm sau phản ứng tăng hay giảm bao nhiêu gam. Cho rằng toàn bộ kim loại sinh ra bám hoàn toàn vào thanh nhôm. Đáp án a) Nồng độ phần trăm của \(C{u^{2 + }}\) trong dung dịch là 0,1664%. b) \(2Al + 3C{u^{2 + }} \to 2A{l^{3 + }} + 3Cu\) Tìm số mol \(C{u^{2 + }}\): \({n_{C{u^{2 + }}}} = {n_{BaC{l_2}}} = 0,00052\left( {mol} \right)\) Tìm số mol Al \({n_{Al}} = {2 \over 3}{n_{Cu}} = {{0,00052.2} \over 3} = 0,00035\left( {mol} \right)\) Theo phương trình trên 2 mol Al tham gia phản ứng, khối lượng sẽ tăng 192 - 54 = 138 (g). 0,00035 mol Al tham gia phản ứng, khối lượng tăng là: \(m = {{138.0,00035} \over 2} = 0,024\left( g \right)\) Sachbaitap.com
Xem lời giải SGK - Hóa 12 Nâng cao - Xem ngay >> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
Xem thêm tại đây:
Bài 33. Nhôm
|
-

Câu 6.49 trang 57 Sách bài tập (SBT) Hóa Nâng cao
Chỉ dùng một thuốc thử nào sau đây có thể nhận biết được mỗi chất?
-
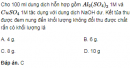
Câu 6.51 trang 57 Sách bài tập (SBT) Hóa Nâng cao
Kết tủa thu được đem nung đến khối lượng không đổi thu được chất rắn có khối lượng là

 Tải ngay
Tải ngay









