Bài 32.7 Trang 46 Sách bài tập (SBT) Hóa học 8Dẫn luồng khí H2 dư đi qua 16 g hỗn hợp hai oxit CuO và Fe2O3 nung nóng. Sau phản ứng để nguội, cân lại thấy khối lượng hỗn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxit trong hỗn hợp đầu. Dẫn luồng khí H2 dư đi qua 16 g hỗn hợp hai oxit CuO và Fe2O3 nung nóng. Sau phản ứng để nguội, cân lại thấy khối lượng hỗn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxit trong hỗn hợp đầu. Trả lời Phương trình hóa học của phản ứng: \(CuO\,\,\,\,\, + \,\,\,\,\,\,{H_2}\buildrel {{t^o}} \over\longrightarrow Cu + \,\,\,\,\,\,{H_2}O\) x mol x mol \(F{e_2}{O_3}\,\,\,\,\, + \,\,\,\,3{H_2}\buildrel {{t^o}} \over\longrightarrow 2Fe + \,\,\,\,\,\,\,\,\,\,\,3{H_2}O\) y mol 2y mol Ta có : Khối lượng hỗn hợp giảm = \(({m_{CuO}} + {m_{F{e_2}{O_3}}}) - ({m_{Cu}} + {m_{Fe}})\) \( \Leftrightarrow 16 - (64x + 112y) = 16 \times {{25} \over {100}}\) \( \to 16x + 28y = 3\) Ta có hệ phương trình \(\left\{ \matrix{80x + 160y = 16 \hfill \cr 16x + 28y = 3 \hfill \cr} \right. \Rightarrow \left\{ \matrix{x = 0,1 \hfill \cr y = 0,05 \hfill \cr} \right.\) \( \to {m_{CuO}} = 0,1 \times 80 = 8(g);{m_{F{e_2}{O_3}}} = 0,05 \times 160 = 8(g)\) \( \to \% {m_{CuO}} = \% {m_{F{e_2}{O_3}}} = 50\% \) .
Xem lời giải SGK - Hóa 8 - Xem ngay >> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
Xem thêm tại đây:
Bài 32: Phản ứng oxi hóa - khử
|
-

Bài 32.8 Trang 46 Sách bài tập (SBT) Hóa học 8
Cho H2 khử 16 g hỗn hợp FeO và CuO trong đó CuO chiếm 25% khối lượng a) Tính khối lượng Fe và khối lượng Cu thu được sau phản ứng.
-
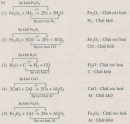
Bài 32.9 Trang 46 Sách bài tập (SBT) Hóa học 8
Người ta dùng khí cacbon oxit để khử đồng(II) oxit. Nếu khử a gam đồng(II) oxit thì thu được bao nhiêu gam đồng ? Cho a = 150 g, hãy tính kết quả bằng số
-
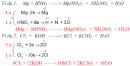
Bài 32.11 Trang 46 Sách bài tập (SBT) Hóa học 8
Người ta điều chế được 24 g đồng bằng cách dùng hiđro khử đồng(II) oxit.

 Tải ngay
Tải ngay