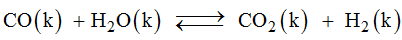Bài 7.19 trang 69 Sách bài tập (SBT) Hóa học 10 Nâng caoGiải bài 7.19 trang 69 Sách bài tập (SBT) Hóa học 10 Nâng cao. Tính nồng độ cân bằng của các chất tham gia và tạo thành ở phản ứng. Bài 7.19 trang 69 SBT Hóa Học 10 Nâng cao Tính nồng độ cân bằng của các chất tham gia và tạo thành ở phản ứng:
Nếu lúc đầu chỉ có CO và hơi nước với nồng độ [CO] = 0,1 mol/l, [H2O] = 0,4 mol/l, và hằng số cân bằng của phản ứng ở nhiệt độ đã cho là 1. Giải Đặt nồng độ cân bằng của CO2 là x mol/l thì nồng độ cân bằng của H2 là x mol/l, của CO là mol/l và của H2O là mol/l. \(\eqalign{ Vậy nồng độ cân bằng của CO2 là 0,08 mol/l; của H2 là 0,08 mol/l; của CO là 0,02 mol/l và của H2O là 0,32 mol/l. Sachbaitap.com
Xem thêm tại đây:
Bài 50: Cân bằng hóa học
|
-

Bài 7.20 trang 69 Sách bài tập (SBT) Hóa học 10 Nâng cao
Giải bài 7.20 trang 69 Sách bài tập (SBT) Hóa học 10 Nâng cao. Dựa vào giá trị hằng số cân bằng của phản ứng dưới đây, hãy cho biết phản ứng nào có hiệu suất cao nhất và phản ứng nào có hiệu suất thấp nhất?
-
Bài 7.21 trang 69 Sách bài tập (SBT) Hóa học 10 Nâng cao
Giải bài 7.21 trang 69 Sách bài tập (SBT) Hóa học 10 Nâng cao. Khi hỗn hợp phản ứng đang ở trạng thái cân bằng, những thay đổi dưới đây sẽ có ảnh hưởng thế nào đến vị trí cân bằng?
-

Bài 7.22 trang 69 Sách bài tập (SBT) Hóa học 10 Nâng cao
Giải bài 7.22 trang 69 Sách bài tập (SBT) Hóa học 10 Nâng cao. Sự thay đổi áp suất có thể gây ra sự chuyển dịch cân bằng của mọi phản ứng thuận nghịch hay không? Giải thích.
-

Bài 7.23 trang 70 Sách bài tập (SBT) Hóa học 10 Nâng cao
Giải bài 7.23 trang 70 Sách bài tập (SBT) Hóa học 10 Nâng cao. Những điều khẳng định sau đây đúng hay sai?

 Tải ngay
Tải ngay