Bài 7.78, 7.79, 7.80, 7.81, 7.82, 7.83 trang 85 sách bài tập (SBT) Hóa học 127.78. Cho hỗn hợp Fe, Cu phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là 7.78. Cho hỗn hợp Fe, Cu phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là A. Cu(NO3)2. B. HNO3. C. Fe(NO3)2. D. Fe(NO3)3. 7.79. Cho các phản ứng : \(\eqalign{ Số phản ứng tạo ra kim loại Cu là A. 2. B.3. C. 1 D. 4 7.80. Nhận định nào sau đây không đúng ? A. Cu là kim loại chuyển tiếp, thuộc nhóm IB, chu kì 4, ô số 29 trong bảng tuần hoàn. B. Cu là nguyên tố s, có cấu hình electron : [Ar]3d1094s1. C. Cấu hình electron của ion Cu+ là [Ar]3d,10 và Cu2+ là [Ar]3d9. D. So với kim loại nhóm IA, liên kết trong đơn chất đồng vững chắc hơn. 7.81. Khi Cu phản ứng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là A. chất xúc tác. B. chất oxi hoá. C. chất khử. D. môi trường. 7.82. Trong không khí ẩm (có chứa CO2), kim loại Cu thường bị bao phủ bởi một lớp màng màu xanh là A. CuCO3 B. CuSO4. C. Cu(OH)2. D. CuCO3.Cu(OH)2 7.83. Có 4 dung dịch muối riêng biệt : CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH dư rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là ' A. 1. B. 2. C.3 D. 4. Hướng dẫn trả lời:
Sachbaitap.com
Xem lời giải SGK - Hóa 12 - Xem ngay >> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
Xem thêm tại đây:
Bài 35. ĐỒNG VÀ HỢP CHẤT CỦA ĐỒNG
|
-

Bài 7.87 trang 86 sách bài tập (SBT) Hoá học 12
Nguyên tử đồng có 1 electron ở lớp ngoài cùng nhưng tại sao đồng có hoá trị II ? Đồng tác dụng như thế nào với các axit ?
-

Bài 7.88 trang 86 sách bài tập (SBT) Hóa học 12
Bột đồng có lẫn tạp chất là bột thiếc, kẽm, chì. Hãy nêu phương pháp hoá học đơn giản để loại bỏ tạp chất. Viết phương trình hoá học của phản ứng dạng phân tử và ion thu gọn.
-
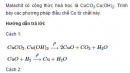
Bài 7.89 trang 87 sách bài tập (SBT) Hóa học 12
Malachit có công thức hoá học là CuCO3.Cu(OH)2. Trình bày các phương pháp điều chế Cu từ chất này.

 Tải ngay
Tải ngay








