Bài 44.1 Trang 60 Sách bài tập (SBT) Hóa học 8Cân 10,6 g muối Na2CO3 cho vàồ cốc chia độ. Rót vào cốc khoảng vài chục mililít nước cất, khuấy cho muối tan hết Cân 10,6 g muối Na2CO3 cho vàồ cốc chia độ. Rót vào cốc khoảng vài chục mililít nước cất, khuấy cho muối tan hết. Sau đó rót thêm nước vào cốc cho đủ 200 ml. Ta được dung dịch Na2CO3 có khối lượng riêng là 1,05 g/ml. Hãy tính nồng độ phần trăm và nồng độ mol của dung dịch vừa pha chế. Trả lời Nồng độ phần trăm của dung dịch pha chế: - Khối lượng của dung dịch Na2CO3 : \({m_{{\rm{dd}}}} = 1,05 \times 200 = 210(g)\) - Nồng độ phần trăm của dung dịch \(C\% = {{100\% \times 10,6} \over {210}} \approx 5,05\% \) Nồng độ mol của dung dịch pha chế: - Số mol Na2CO3 trong dung dịch: \({n_{N{a_2}C{O_3}}} = {{10,6} \over {106}} = 0,1(mol)\) - Nồng độ mol của dung dịch : \({C_M} = {{1000 \times 0,1} \over {200}} = 0,5(mol/l)\).
Xem lời giải SGK - Hóa 8 - Xem ngay >> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
Xem thêm tại đây:
Bài 44: Luyện tập chương 6 - Hóa học 8
|
-
Bài 44.2 Trang 60 Sách bài tập (SBT) Hóa học 8
Có : CuSO4 và nước cất. Hãy tính toán và trình bày cách pha chế để có được những sản phẩm sau :
-
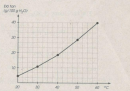
Bài 44.3 Trang 60 Sách bài tập (SBT) Hóa học 8
Bảng dưới đây cho biết độ tan của một muối trong nước thay đổi theo nhiệt độ :
-

Bài 44.4 Trang 60 Sách bài tập (SBT) Hóa học 8
Người ta pha chế một dung dịch NaCl ở 20°C bằng cách hoà tan 23,5 g NaCl trong 75 g nước. Căn cứ vào độ tan của NaCl
-
Bài 44.5 Trang 61 Sách bài tập (SBT) Hóa học 8
Hãy tính toán và trình bày cách pha chế 0,5 lít dung dịch H2SO4 có nồng độ 1M từ H2SO4 có nồng độ 98%, khối lượng riêng là 1,84 g/ml.

 Tải ngay
Tải ngay





